
Todos los átomos están formados por tres partículas más pequeñas llamadas protones, neutrones y electrones. Los protones y neutrones se agrupan en el centro de un átomo y los electrones orbitan lejos. Los átomos se pueden combinar para formar moléculas mediante reacciones químicas.
Para comprender mejor la estructura atómica…
¡ESTUDIÉMOSLO PASO A PASO!
Estructura atómica
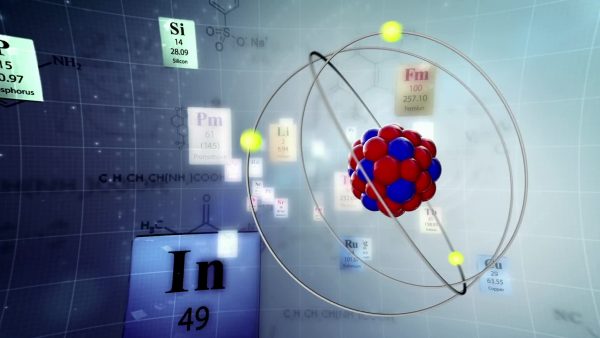
El centro del átomo, a menudo denominado núcleo, está formado por protones y neutrones. Los protones tienen carga positiva, mientras que los neutrones no tienen carga. Los electrones orbitan alrededor del exterior del átomo a una velocidad y distancia tremendas. Los electrones son las más pequeñas de las tres partículas subatómicas y tienen carga negativa. El espacio vacío se encuentra entre el núcleo atómico y los electrones.
Átomos microscópicos

Los átomos son extremadamente pequeños. Los átomos son más de 10.000 veces más pequeños que el ancho de un cabello. Incluso un microscopio de aula no podría ver nada cercano al tamaño de un átomo. Un microscopio especializado llamado microscopio de túnel de barrido desarrollado en la década de 1980 puede mostrarnos átomos individuales. Si observara algunas limaduras de hierro con un microscopio de túnel de barrido, sería capaz de ver pequeñas esferas de átomos de hierro.
Identificación de átomos
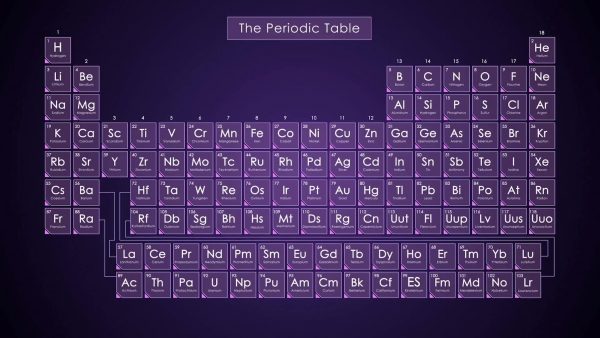
Cada elemento tiene una cierta cantidad de protones, neutrones y electrones. Podemos encontrar esta información haciendo referencia a la tabla periódica de elementos. Por ejemplo, el elemento número 6 en la tabla es el carbono, que se indica con la letra C. La tabla periódica también nos muestra que el número atómico del carbono es 6. El número atómico nos dice cuántos protones y electrones hay en el elemento. A partir de esta información, sabemos que el carbono tiene 6 protones y 6 electrones.
Elementos y moléculas

Los elementos se pueden combinar para formar moléculas. El agua, por ejemplo, es H2O. Esto significa que 2 átomos de hidrógeno están unidos a un átomo de oxígeno. Hay infinitas combinaciones de átomos que forman toda la materia. Algunos son simples como el agua, mientras que otros son mucho más complicados como la hemoglobina. Una molécula de sacarosa, lo que conocemos como azúcar de mesa, está formada por 12 átomos de carbono, 22 átomos de hidrógeno y 11 átomos de oxígeno. La sacarosa se puede escribir en una notación abreviada como esta: C12H22O11.
Carreras en química

El campo principal de la ciencia que estudia los átomos y las moléculas se llama química. Los químicos usan su conocimiento de los átomos para crear moléculas que pueden usarse como medicinas. Para hacer moléculas, necesitan saber cuáles reaccionan juntas y en qué orden reaccionar. Otros tipos de científicos, como los bioquímicos, estudian enormes moléculas creadas por la naturaleza, como las proteínas y el ADN. La producción de moléculas de insulina para tratar la diabetes fue posible gracias al trabajo de los bioquímicos.
VOCABULARIO DE ÁTOMOS Y MOLÉCULAS
PREGUNTAS DE DISCUSIÓN DE ÁTOMOS Y MOLÉCULAS
¿Qué verías si observaras las limaduras de hierro con un microscopio de túnel de barrido?
Describe las diferentes partículas que componen un átomo.
¿Cuáles son algunos ejemplos de elementos? ¿Cómo sabes que son elementos?
¿Cómo puedes utilizar la tabla periódica de los elementos para encontrar información sobre elementos específicos?
¿Cómo llegaron los científicos a la conclusión de que la mayor parte de un átomo es espacio vacío?
¿Cuáles son algunas de las carreras disponibles para las personas que desean estudiar átomos y moléculas?
Skip, I will use a 3 day free trial
Enjoy your free 30 days trial
We use cookies to make your experience with this site better. By using this site you agree to our use of cookies. Click "Decline" to delete and block any non-essential cookies for this site on this specific property, device, and browser. Please read our privacy policy for more information on the cookies we use.Learn More
We use cookies to improve your experience. By using this site, you agree to our use of cookies. Click "Decline" to block non-essential cookies. See our privacy policy for details.Learn More






